
01.概述
卵巢癌是最致命的妇科恶性肿瘤。尽管引入了贝伐单抗,但标准化疗基本上没有变化,绝大多数患者在诊断的前两年内会复发。然而,临床实践结果表明PARP抑制剂治疗的临床益处正在迅速改变许多卵巢癌患者的治疗选择。
相关临床试验表明,在对以铂类为基础的化疗进行初始完全缓解(CR)或部分缓解(PR)后,将其用作维持治疗对原发性和复发性卵巢癌有益处。这可以部分地由具有同源重组缺陷(HRD)的肿瘤的高患病率来解释,在约50%的所有卵巢癌中发现了HRD。BRCA1/2缺陷约占这些病例的20%[1]。这是PARPis在BRCA1/2突变携带者和HR缺陷肿瘤患者中的分子原理和显著临床益处的基础。虽然它也显示了BRCA1/2wt和HR相关肿瘤患者的PFS显著延长,但与上述其他亚组相比,这种显著的临床益处较少。
02.理解耐药的潜在机制对于增强PARP抑制在卵巢癌中的临床应用至关重要
尽管相关临床试验通过显著改善PFS显示了有前景的结果,但关键问题仍然存在。很明显,大多数患者最终会对PARPi产生耐药性。耐药时间可能取决于PARPis疗效的独特性,即BRCA突变和HRD状态。人们可以推测,肿瘤中HRD的复杂程度是耐药性发展的基础。这意味着,如果PARPi不“需要”抵消(相对)复杂的机制,对PARPi的耐药性会发展得更快[2]。这一假设基于临床观察,即在对以铂类为基础的化疗反应后,与HR缺陷或BRCA1/2突变肿瘤患者相比,被归类为“HR功能正常”的肿瘤患者从PARPis中获益较少。对奥拉帕利长期和短期应答者的基因组分析表明,奥拉帕利应答与BRCA1/2突变相关。进一步推测,BRCA突变的潜在类型可以更准确地预测长期反应者。类似地,更准确的HRD测试可以让我们更好地理解对PARP抑制产生持续临床反应的因素。一方面,识别新生物标志物的潜在方法是揭示对PARP抑制无反应的患者的潜在耐药机制。另一方面,鉴定接受PARPi治疗的BRCAwt和HR功能正常肿瘤的长期存活者并表征可能预测这种异常反应的潜在生物标志物将是至关重要的。这一令人兴奋的途径也将阐明提高PARPi功效的潜在策略。
03.耐药机制和提高疗效的策略
PARPi抗性的许多潜在机制已经被研究。PARPis临床开发的最强有力的理论基础源于在BRCA1/2缺陷(和HR缺陷)细胞中观察到的反应。因此,一个耐人寻味的耐药机制涉及肿瘤细胞中BRCA1/2基因的次级体细胞回复突变,其本质上恢复HR。这可能是由于化疗引起的肿瘤异质性和克隆性扩增,称为“达尔文逃逸”。有研究比较原发性卵巢癌和复发性卵巢癌,结果显示,46例复发性HGSOC中有13例存在继发性突变,64例原发性HGSOC中有2例为种系BRCA1/2突变携带者[3]。这在铂类耐药和铂类敏感的卵巢癌中更加明显,几乎50%的铂类耐药卵巢癌(26例中的12例)显示BRCA1/2回复突变。在卵巢癌和其他癌症中,BRCA1/2的次级反向突变也显示与PARPi抗性相关。最有趣的是,通过分析前列腺癌患者的循环游离DNA(cfDNA),已经检测到BRCA1/2等位基因的次级回复突变。这将提供一种非侵入性方法来更准确地预测对基于铂的化疗和/或PARPi治疗的效果[4]。影响基因表达的其他机制包括BRCA1/2超甲基化等。RAD51是HR机制的一个组成部分,其二次回复突变可能导致接受rucaparib治疗的铂类药物敏感型HGSOC患者产生PARPi耐药性。
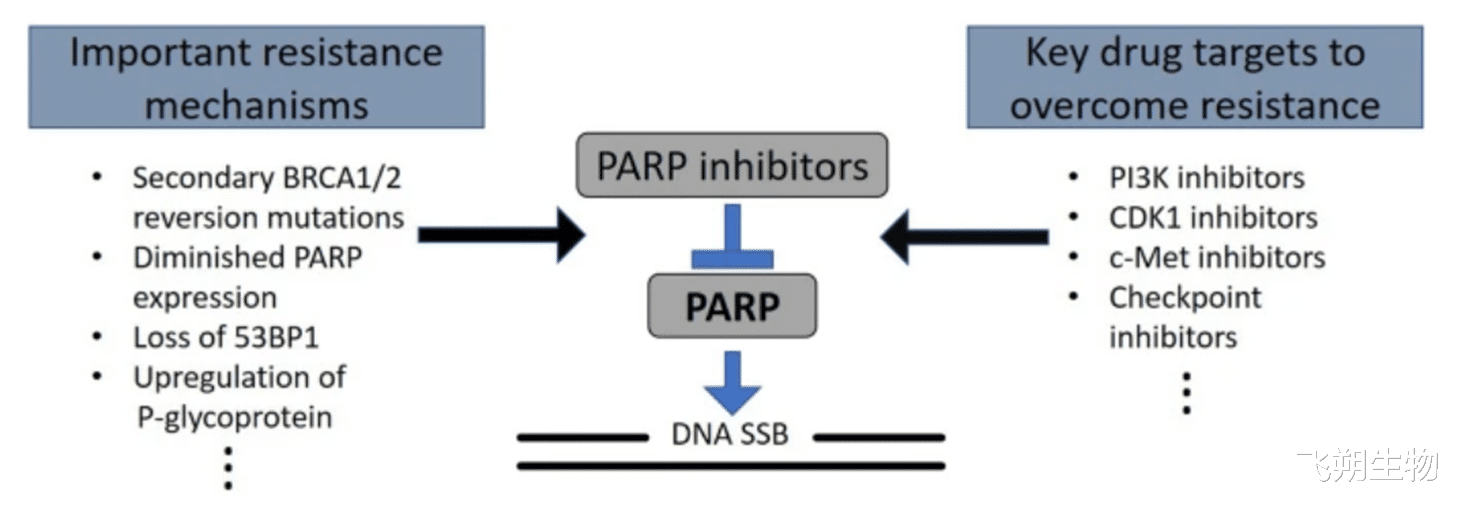
联合治疗的耐药机制和潜在靶点。耐药机制和潜在药物靶点的总结,以及可与PARPi联合使用的相应抑制剂。
然而,PARPi的功效也可能受到恢复HR的BRCA非依赖性机制的影响。TP53结合蛋白1(53BP1)是决定DNA DSBs修复途径的另一个重要因素。它拮抗BRCA1并抑制DNA双链断裂的末端切除,因此有利于NHEJ。反过来,53BP1的缺失显示出在BRCA缺失的情况下,通过潜在促进DNA DSB末端切除和RAD51募集而有利于HR。在肿瘤样本中,53BP1的低表达水平与HRD卵巢癌患者对PARPis反应较差相关。在三阴性乳腺癌模型中,53BP1的缺失弥补了BRCA缺陷,降低了化疗敏感性,并与较差的预后相关。这表明在患者中测试53BP1状态以评估PARP抑制的有效性具有临床意义。类似地,下游因子53bp1(rev7)的缺失也显示出在BRCA缺陷细胞中恢复HR,导致PARPi抗性。如何缓解这种耐药性机制还有待观察。人们可以推测,在这种情况下,尚未发现的激活或稳定53BP1的因子可用于恢复药物功效[5]。
另一种可能性是肿瘤细胞中PARP-1表达的丢失或减少,因为它们本质上缺乏药物靶点。对于依赖于DNA结合复合物形成的PARP捕获机制来说尤其如此。这表明稳定的PARP-DNA复合物有助于PARP抑制的细胞毒性作用。其他耐药机制与PARP-1和PARG之间的动态平衡有关。后者抑制PARylation,并有效地作为生理PARPi起作用,这是完全阻断PARPi处理的细胞中的PARylation所需要的。
除了涉及p-糖蛋白的一般药物流出机制外,PARPi耐药性可能依赖于损害PARPi功效的其他潜在“可用药”因素。因此,如果可以避开耐药机制,PARPi敏感性可以通过联合治疗来恢复[6]。
细胞周期蛋白依赖性激酶(CDK)的抑制被认为可以使BRCA细胞对PARPis敏感。它们在细胞周期进程和DNA损伤控制中起关键作用,也直接影响BRCA1/2。CDK1通过结合细胞周期蛋白B1促进有丝分裂进程。CDK1对BRCA1的磷酸化对下游信号传导的激活和病灶的形成也很重要。反过来,失去对CDK1的抑制会损害BRCA功能,产生一种“癌症”状态。在乳腺癌细胞中显示,损害CDK1活性(通过消除或抑制)使细胞对BRCA肿瘤中的PARPis敏感。显示这是一个有吸引力的药物靶点,因为市面上有很多CDK抑制剂。Given CDK4/6抑制剂,如palbociclib或ribociclib,已经获准用于激素受体阳性乳腺癌,这可能有助于早期临床应用,因为对于相对类似类别的药物已有大量临床经验。
另一种组合是PI3K抑制剂与PARPi的组合,是一种经过充分研究的、相对成熟的扩展PARPi应用的方法。与CDK1抑制剂类似,PI3K抑制剂在BRCA细胞中产生一种“癌症”状态。已有研究表明,PI3K抑制剂(BKM120)下调细胞系和患者来源的异种移植物中BRCA的表达。这是由ERK信号通过转录因子ETS1介导的。PI3K抑制的其他机制可能是RAD51对DNA DSBs位点的募集受损,从而降低HR。最近一项联合应用PI3K和PARP抑制剂的I期临床试验前景很好,值得进一步临床评估。鉴于各种(预)临床试验的联合疗法,有一些有前景的策略可以增强PARPi的临床应用。尤其需要提高BRCAwt肿瘤患者的临床疗效,因为PARPi在该患者群组中的效果相对较小。另一方面,更准确地预测PARPi在HRD和(在较小程度上)BRCA突变携带者患者中的疗效将至关重要[7]。
04.未来前景
虽然不同的联合治疗可能会提高PARPi的疗效并规避耐药机制,但确定最有可能受益的患者是至关重要的。因此,需要识别足够的预测性生物标志物,以帮助准确的患者选择。
筛查HRD而不是仅仅依赖于对铂类化疗的临床反应,将提供更准确的患者分层。这显然取决于进一步的表征是否能为患者带来更好的治疗选择,以及这种检测的可用性和可重复性。尽管如此,这将使更多的患者有机会接受PARPi治疗,并有可能获得额外的靶向治疗。
不少正在进行的临床试验正在评估PARPi联合贝伐单抗或检查点抑制剂的维持治疗。目前有几项临床试验研究PARPi与检查点抑制剂联合用于卵巢癌(NCT03806049、NCT03574779、NCT03598270、NCT02657889、NCT02953457、NCT03522246和NCT03737643)。这些联合用药是否显示出显著的临床疗效并提高总生存率还有待观察。
参考文献
[1] Carcinogenesis. 2012;33(11):2026-2034.
[2] Nature. 2012;481(7381):287-294.
[3] ESMO Open. 2018;3(5):e000368
[4] Ann Oncol. 2017;28(3):512-518.
[5] Lancet Oncol. 2019;20(4):570-580.
[6] Nat Med. 2016;22(2):194-201.
[7] Nature. 2015;521(7553):541-544.
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!