长期以来,神经药物研发一直处于一个两难困境中:为了理解人类大脑的疾病并寻找治疗方法,科学家不得不依赖小鼠模型——用小白鼠的大脑来模拟人脑的复杂功能。然而,鼠脑与人脑在基因、结构和生理层面存在显著差异。因此大量在动物实验中表现良好的候选药物,一旦进入人体临床试验阶段便纷纷失效。其中,神经类药物的临床失败率高达 99%。
最近,一项来自加州大学河滨分校(University of California, Riverside, UCR)的最新突破,可能有望为这一困局打开新的突破口。由生物工程副教授 Iman Noshadi 领衔的团队在材料科学顶级期刊 Advanced Functional Materials《先进功能材料》上发表了一项关键成果:他们首次构建出完全不含动物成分的脑类组织支架,如果后续成功投入使用,药物测试可能无需使用小白鼠等动物。

图 | Iman Noshadi(来源: UCR 官网)
这次的脑类组织支架并非普通的实验室模型——它的核心突破在于“完全合成”:无需动物源性蛋白(如层粘连蛋白或纤维蛋白),也无需成分不清的生物涂层。
在过往的组织工程研究中,科学家如果想在培养皿里养脑细胞,通常需要一种基质来充当脚手架。最常用的材料之一叫做 Matrigel,这是一种从主要由层粘连蛋白和胶原蛋白组成的凝胶混合物。
它通常提取自小鼠肉瘤组织。但这种动物源性的材料有一个致命的弱点:批次之间的差异性极大。这种不确定性是药物测试的大敌,因为你永远不知道实验结果的波动是因为药物本身,还是因为那批基质里混入了某种动物的生长因子。
为了提升实验的准确性,UCR 的研究团队选择彻底绕开动物成分,他们把目光投向了一种工业上非常常见的聚合物——聚乙二醇(Polyethylene Glycol,简称 PEG)。这种材料化学性质极其稳定,在医药和化妆品中随处可见。但对于细胞来说,PEG 有一个巨大的缺点:它过于光滑了。在微观尺度上,PEG 就像是一个不粘锅,细胞根本无法在上面附着,生长和分化则更加困难。传统的方法是向 PEG 中掺入层粘连蛋白等动物分子来增加黏性,但这又绕回了依赖动物成分的老路。

图 | 聚乙二醇(来源: ikuca)
因此,UCR 团队并没有试图改变 PEG 的化学性质,而是选择在物理结构上做文章。他们开发了一种名为 BIPORES(Bijel-Integrated PORous Engineered System,双连续界面阻塞乳液集成多孔工程系统)的全新制造工艺。
它基于一种被称为“Bijel”(双连续界面阻塞乳液凝胶)的软物质形态。想象一下油和水混合时的状态,如果你能在它们试图分离但还没完全分开的那一瞬间,用无数微小的颗粒将它们彼此的界面卡住,你就得到了一种内部通道四通八达、且结构极其稳定的网状物。
研究团队利用微流控技术,设计了一种精巧的同轴喷嘴。他们将 PEG 前体溶液、乙醇和水混合,从喷嘴内部喷出,同时外层包裹着盐水流。当这两股流体相遇时,乙醇迅速扩散,引发了一种被称为“旋节线分解”(Spinodal Decomposition)的相分离过程。就在 PEG 试图从水中分离出来的瞬间,混合液中预先加入的二氧化硅纳米颗粒(Silica Nanoparticles)迅速游动到了油水界面上,像无数个微小的锚一样,将这个瞬间的结构永久地固定了下来。
随后,团队利用光聚合作用,让整个结构瞬间硬化,最终形成一根根直径约为两毫米的纤维。但如果用电子显微镜放大观察,你会发现这些纤维内部是一个由无数微孔组成的迷宫,孔径分布在 5 到 50 微米之间,且具有一种特殊的几何特征——负高斯曲率(Negative Gaussian Curvature)。
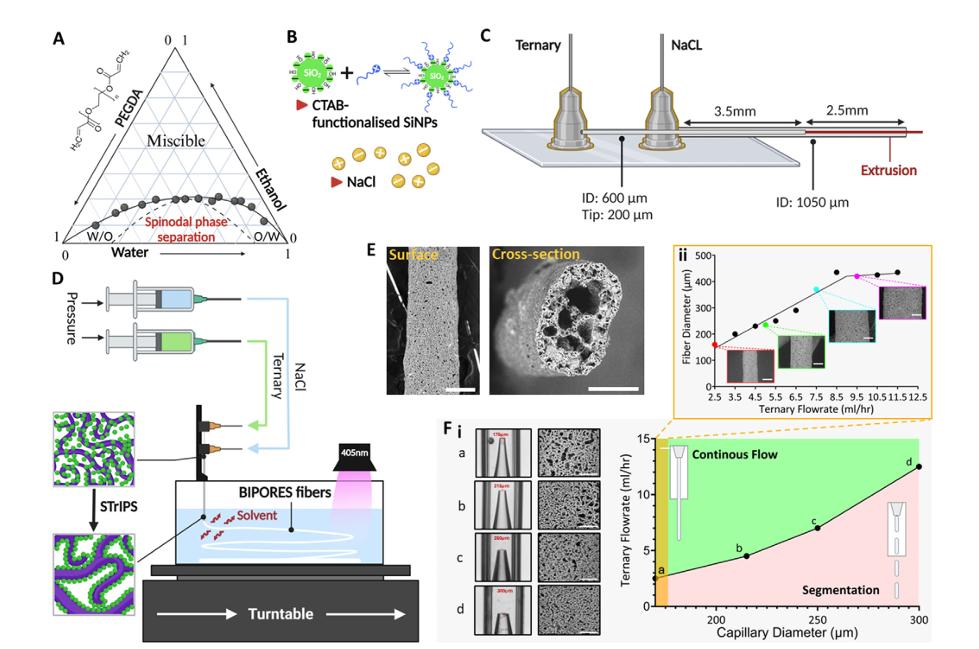
图 | BIPORES 工艺流程图(来源:团队论文)
这种曲面并不是平滑的,而是像马鞍一样起伏。对于细胞来说,这种结构是完美的攀岩墙。原本在 PEG 表面无处借力的神经干细胞,在遇到这种结构时,表现出了惊人的适应性。实验数据显示,在没有任何生物涂层辅助的情况下,人类诱导多能干细胞衍生的神经干细胞(i-HNSCs)在接触 BIPORES 支架后的 30 秒内就完成了附着。这在过去被认为是 PEG 材料不可能完成的任务。
在微观世界里,结构即是细胞的信号指引。BIPORES 支架内部相互连通的孔隙网络,不仅允许氧气和营养物质像在真实血管中一样自由流动,带走代谢废物,更重要的是,这种特殊的曲面结构似乎能给细胞传递某种机械信号。研究人员观察到,神经干细胞不仅在这个合成支架上活了下来,而且开始自发地分化。
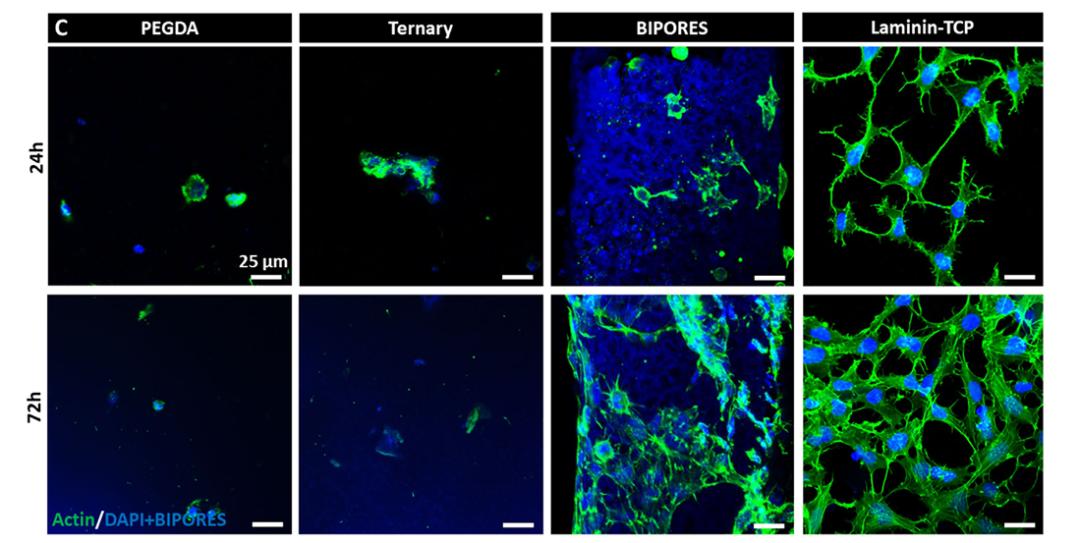
图 | 神经干细胞在支架上附着、铺展和生殖(荧光标记绿色为细胞骨架,蓝色为细胞核)(来源:团队论文)
在为期 28 天的培养周期中,这些干细胞逐渐分化成了神经元和星形胶质细胞。更令人兴奋的是,它们并没有像在普通培养皿里那样杂乱无章地生长,而是沿着支架的孔隙形成了复杂的、三维的神经网络。当研究人员使用钙成像技术(Calcium Imaging)来观察这些细胞时,他们捕捉到了代表神经活动的荧光信号。
这表示,这些神经元正在“交谈”——它们产生了自发的钙离子瞬变,频率明显高于传统培养条件下的对照组。这意味着,在这个完全由化学合成材料构建的迷宫里,细胞们不仅安了家,还建立起了功能性的突触连接,形成了一个真正活着的微型神经网络。
这项技术的出现,正值美国食品药品监督管理局(FDA)积极推动《FDA 现代化法案 2.0》,其核心目标之一就是逐步减少甚至取消新药研发中对动物实验的强制要求。监管机构和制药公司都已意识到,动物模型与人类生理之间巨大的遗传差异,是导致药物研发成本高企、成功率低下的核心原因之一。然而,要真正取代动物实验,我们需要足够可靠、可重复且高度仿真的体外模型。

图 | FDA 现代化法案 2.0:减少动物实验(来源:biobide)
UCR 团队开发的这种全合成脑组织模型,恰恰击中了这一痛点。由于不含任何动物源成分,BIPORES 支架的生产过程可以像制造微芯片一样标准化。对于制药公司而言,这意味着他们可以在一个高度可控的基准线上测试新药,任何实验数据的变化都可以确信是由药物引起的,而不是因为这批支架里的某种老鼠蛋白含量超标。
此外,这种支架的稳定性也为长期研究提供了可能。许多神经退行性疾病,如阿尔茨海默病或渐冻症。传统的凝胶支架往往在培养几周后就会开始降解或收缩,难以支撑长达数月的实验。而 BIPORES 支架由于是由交联的聚合物和二氧化硅颗粒构成,结构异常稳固。在实验中,这种支架在长达数月的培养过程中保持了形态的完整,这使得科学家们首次有机会在体外模拟那些需要长期观察的慢性神经疾病进程。
更有意思的是,这项技术的潜力远不止于大脑。Iman Noshadi 教授在接受采访时透露,虽然目前的模型主要针对脑组织,但 BIPORES 技术的原理是通用的。通过调整微流控芯片的参数,他们可以精确控制支架的孔径大小和纤维排列方式,从而模拟出肝脏、心脏或肌肉等不同组织的微环境。该团队已经提交了一篇关于利用同样技术构建肝脏组织模型的新论文。
想象一下,将合成的大脑、肝脏和心脏模型通过微流体管道连接起来,模拟药物在人体内的代谢和副作用。比如,我们可以观察一种治疗脑部疾病的药物,在通过肝脏代谢后是否会产生毒性副产物,进而影响心脏功能。这种系统级的人体模拟,将改变药物筛选的流程。
目前的合成脑组织还处于早期阶段。现在的模型直径仅有两毫米左右,虽然对于微观研究已经足够,但要构建更大尺度的组织,还需要解决内部血管化等更复杂的工程难题。UCR 的团队也坦言,目前的成果只是第一步,他们正在努力扩大制造规模,并探索如何在这个合成系统中引入免疫细胞,以模拟更真实的大脑免疫环境。
参考链接:
1.https://news.ucr.edu/articles/2025/11/17/scientists-engineer-first-fully-synthetic-brain-tissue-model
2.https://doi.org/10.1002/adfm.202509452
运营/排版:何晨龙



