转自:医学界
乳腺癌是全球女性中最常见的恶性肿瘤之一,约占每年新发病例的25%,其中大部分患者属于激素受体阳性(HR+)亚型。这一亚型的肿瘤生长依赖于激素信号通路,因此内分泌治疗一直是HR+乳腺癌治疗体系的核心。随着分子诊断和基因表达分析技术的不断进步,乳腺癌的生物学特征被逐步揭示,精准分型与个体化治疗理念日趋成熟。当前,内分泌治疗也正在从传统的“标准化治疗”迈向“精准化调控”。研究者不仅关注药物作用机制的再认识,也在探索如何通过分子标志物、基因检测及联合靶向策略实现真正意义上的“治疗调优(therapeutictuning)”。近期发表的一篇综述文章系统梳理了现有临床证据,探讨了不同内分泌药物类别的作用机制与应用策略,并总结了在绝经前与绝经后HR+乳腺癌患者中实现个体化治疗的关键考量与未来方向[1]。本文将对该综述的重点内容加以整理,以供读者参考。
乳腺癌发生发展的分子与遗传学机制
乳腺癌是一种由多因素共同驱动的异质性疾病,其发生与发展不仅受外界环境及内分泌因素影响,也受到基因突变、信号通路异常及肿瘤微环境重塑等分子生物学事件的影响。其中涉及的基因突变包括胚系突变(遗传性)和体细胞突变(获得性)。胚系突变以BRCA1/2最为典型,体细胞突变如PIK3CA、ESR1、CDH1则在散发性乳腺癌中常见。
随着分子分型技术的发展,乳腺癌可依据基因表达谱被划分为LuminalA、LuminalB、HER2-enriched、Basal-like以及三阴性乳腺癌(TNBC)等亚型。Luminal型肿瘤普遍为HR+,对内分泌治疗敏感;HER2-enriched型因HER2基因扩增表现出高侵袭性;而Basal-like/TNBC亚型则缺乏靶点,预后较差。此分型体系不仅揭示了乳腺癌的分子异质性,也为精准治疗奠定了基础。此外,肿瘤微环境(TME)在耐药形成中扮演关键角色。肿瘤相关成纤维细胞(CAFs)、免疫细胞及局部雌激素浓度可通过多途径促进细胞生长、侵袭及免疫逃逸,为“联合治疗”提供了理论基础。
主要内分泌治疗手段与机制
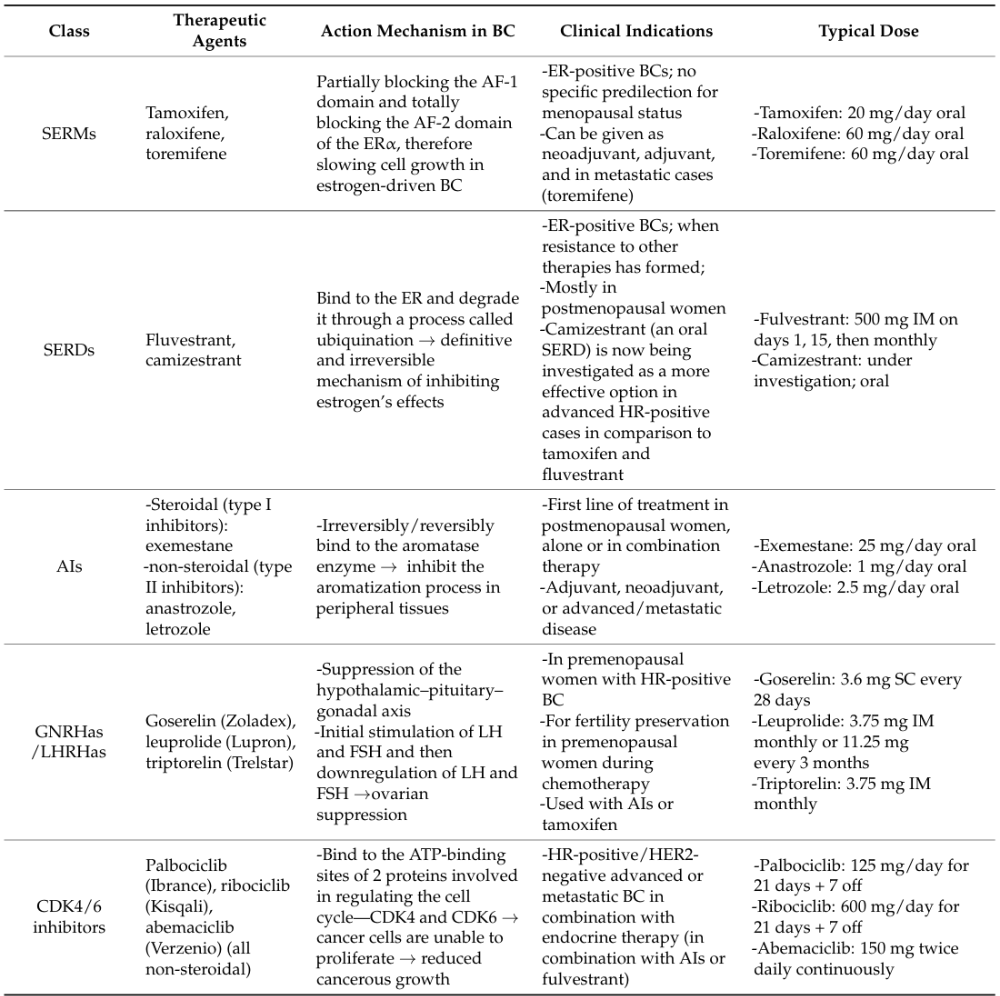
■选择性雌激素受体调节剂(SERMs)
代表药物为他莫昔芬(tamoxifen)。SERM通过竞争性结合雌激素受体(ER),阻断雌激素信号转导,从而抑制肿瘤细胞生长。其兼具拮抗与部分激动活性,在乳腺组织中抑制ER信号、在骨组织中促进骨密度维持。多个研究表明,5年他莫昔芬单药治疗可显著降低早期HR+乳腺癌的复发风险。
■选择性雌激素受体降解剂(SERDs)
代表药物为氟维司群(fulvestrant)。SERD通过结合并诱导ER降解,实现对雌激素信号的“去除式”抑制。相较SERM,其作用更彻底,适用于发生ESR1突变或对其他内分泌治疗产生耐药的患者。
■芳香化酶抑制剂(AIs)
AIs通过抑制芳香化酶(负责将肾上腺产生的雄激素在外周组织(如脂肪组织、肌肉和肝脏)中转化为雌激素的酶)而发挥作用。在绝经后女性中,外周组织中的芳香化作用是雌激素生成的主要途径,这凸显了AIs在此类患者中的治疗价值。AIs可分为两类:甾体类(I型抑制剂)与非甾体类(II型抑制剂)。I型抑制剂(如依西美坦)通过形成共价键与芳香化酶不可逆结合,导致该酶永久失活。而II型抑制剂(如阿那曲唑和来曲唑)则通过可逆性地占据其活性位点,阻断芳香化酶的功能。
■卵巢功能抑制(OFS)
在绝经前女性中,雌激素主要由卵巢分泌,OFS可通过药物干预,靶向下丘脑-垂体-性腺轴,暂时抑制卵巢雌激素的生成;或通过手术干预切除卵巢,永久终止雌激素的产生。药物性OFS常用促性腺激素释放激素激动剂(GnRHa)如戈舍瑞林(goserelin)和亮丙瑞林(leuprolide)等。乳腺癌中的OFS主要应用于早期乳腺癌的辅助内分泌治疗,以及化学治疗期间的卵巢功能保护。
■CDK4/6抑制剂的联合应用
CDK4/6抑制剂通过结合并阻断细胞周期关键调控因子——细胞周期蛋白依赖性激酶4和6(CDK4/6)的ATP结合位点,选择性抑制其活性。CDK4/6抑制剂联合内分泌治疗已成为晚期HR+/HER2-乳腺癌患者的一线治疗方案。代表药物包括派柏西利(palbociclib)、瑞波西利(ribociclib)和阿贝西利(abemaciclib)。
表1常见内分泌治疗药物种类及作用机制
治疗策略优化:基于风险分层的个体化调控
在辅助内分泌治疗中,如何在疗效与长期安全性之间取得平衡,成为临床决策的关键。作者指出,治疗策略应根据绝经状态与复发风险进行动态优化,实现个体化的“治疗调优”。
■治疗强化与风险平衡:绝经前患者的内分泌管理
两项关键研究,TEXT与SOFT研究表明,AI联合OFS相比他莫昔芬联合OFS可进一步降低复发风险并改善无病生存期(DFS),且两种联合方案的疗效均优于单用他莫昔芬。有研究指出,在接受辅助内分泌治疗的早期HR+/HER2-患者中,约有六分之一的淋巴结阳性病例在五年内复发,提示仍存在显著的复发风险。总体来看,低危患者可选择5年他莫昔芬单药治疗,而高危患者(如淋巴结阳性、肿瘤较大或具有其他不良预后因素者)应考虑GnRHa联合他莫昔芬或其他内分泌药物,并可适当延长疗程至10年。
■延长与平衡:绝经后患者的长期管理策略
在绝经后女性中,AI通过抑制外周组织和肾上腺的芳香化反应,阻断雌激素合成,是辅助内分泌治疗的一线方案;而他莫昔芬仅能阻断受体结合,难以显著降低循环雌激素水平,因此疗效相对有限。研究显示,来曲唑在绝经后HR+转移性乳腺癌患者中疗效确切且耐受性良好。关于治疗时长,部分研究认为将AI疗程由额外2年延长至5年并未显著改善结局,且增加骨折风险;而MA17R研究证实,在5年他莫昔芬治疗后再延长5年来曲唑可改善无病生存期。ATLAS和aTTom试验同样表明,将他莫昔芬疗程延长至10年可进一步降低复发和死亡风险。总体来看,AI是绝经后HR+乳腺癌的治疗基石,无法耐受者可选用他莫昔芬,低危患者5年疗程足够,高危患者可考虑延长至10年,以实现疗效与安全性的平衡。
■风险分层:精准决策的基石
内分泌治疗的个体化决策离不开科学的风险分层。评估流程通常包括两个层面:一是临床病理学特征,如肿瘤大小、淋巴结受累、分级、受体状态、增殖指数及特定基因突变等;二是分子层面信息,通过基因检测进一步确定复发风险等级(低、中、高)。近年来,多基因检测工具如OncotypeDX与MammaPrint已被广泛应用,用于分析肿瘤基因表达谱,预测复发风险及化疗获益,尤其适用于早期HR+/HER2-的患者群体,在传统临床指标不足时可提供更精准的指导。与此同时,PAM50等基因组分型平台通过将分子亚型与风险等级结合,进一步提升了预后评估的精确性,为内分泌治疗的“精准调优”奠定了基础。
总结与展望
总体来看,内分泌治疗依然是HR+乳腺癌的治疗基石。随着对肿瘤分子机制的深入理解和新型药物的不断涌现,治疗模式正从“固定方案”转向“精准调控”,通过风险分层与分子检测实现更个体化的决策。未来的研究将聚焦于基因组工具在复发风险预测中的应用、新一代内分泌及靶向药物的联合探索,以及长期管理中疗效与生活质量的平衡。在精准分层与持续创新的共同推动下,HR+乳腺癌有望从“长期控制”逐步迈向“潜在治愈”。
参考文献:
[1]BurciuOM,etal.CurrentEndocrineTherapyinHormone-Receptor-PositiveBreastCancer:FromTumorBiologytotheRationaleforTherapeuticTunning.Medicina(Kaunas).2025Jul16;61(7):1280.
审批编号:CN-171277有效期至:2026-05-22本材料由阿斯利康提供,仅供医疗卫生专业人士参考