说明:本文华算科技系统介绍了电催化领域的核心理论,包括Sabatier原理、吸附–能量标度关系、d带中心理论及活性描述符,结合图示与热力学解释,阐述了催化剂设计与性能评估的基本原则。
什么是Sabatier原理?
原理由诺贝尔奖得主Paul Sabatier于1913年提出,是电催化领域的核心理论之一,其核心思想是:——若吸附过弱,反应物难以活化;若吸附过强,中间产物或产物无法及时脱附,导致活性位阻塞这一原理强调催化剂需平衡吸附与脱附的热力学条件,以促进反应动力学。DFT的成功使结合能计算成为常规实践,将Sabatier原理从经验原则转变为定量预测工具。
原理的图形化表现为,其横坐标为吸附能,纵坐标为催化活性(通常用电流密度或TOF表示)。
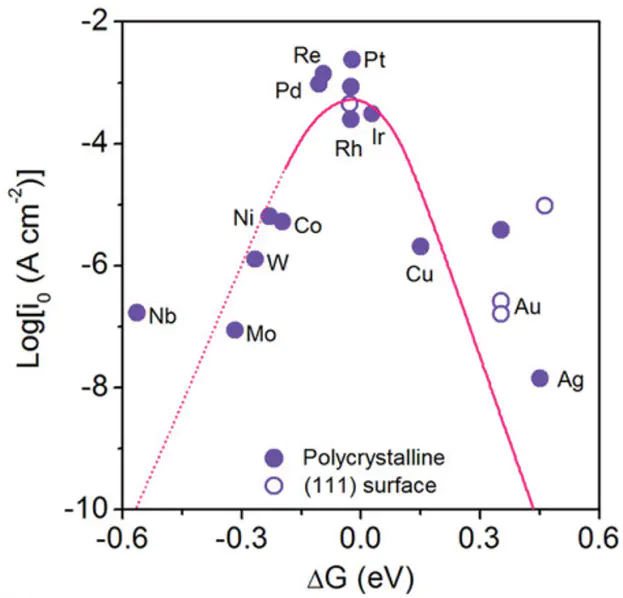
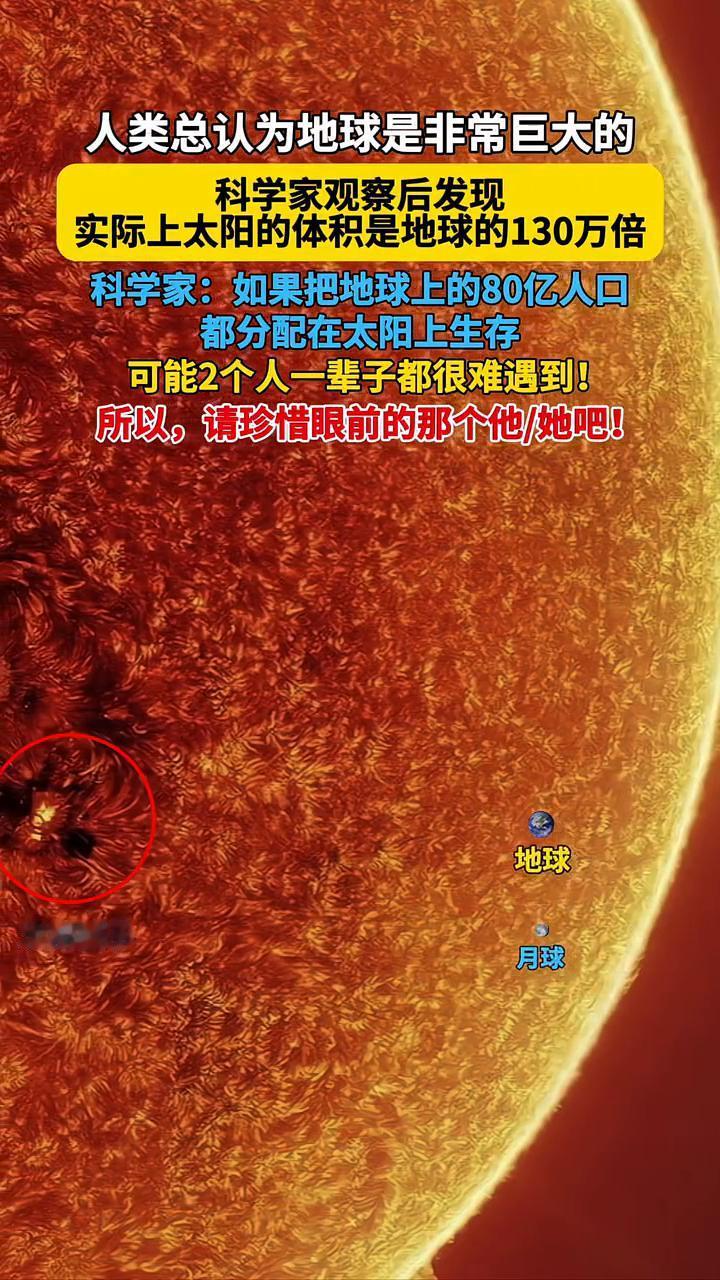
图1 H*的吉布斯自由能和交换电流密度的关系示意图。DOI:10.1002/chin.200524023
Sabatier原理的热力学解释
当施加的电极电位等于半电池电位时,反应物和产物的自由能相等,系统处于平衡状态一旦电极电位偏离半电池电位,例如析氯反应(),则需要,而阴极(还原)反应如析氢反应()则需要。在此框架下,催化剂的作用是调节反应物和产物之间的自由能形貌(FEL)。
CER该中间体吸附到哪个催化剂表面上RI理想的自由能形貌的一般共识是该反应中间体在平衡时具有与反应物和产物相同的自由能。即RI是理想催化剂的标准,并且可以被视为催化活性的“描述符”如果(ΔG<),则第一步在热力学上是不利的(图1A,蓝色线)。另一方面,如果(ΔG>),则第二步在热力学上是不利的。
A表示不同结合强度(ΔG)的反应中间体的自由能形貌()TDDOI不同反应中间体在催化剂表面吸附能之间线性关联的理论框架。
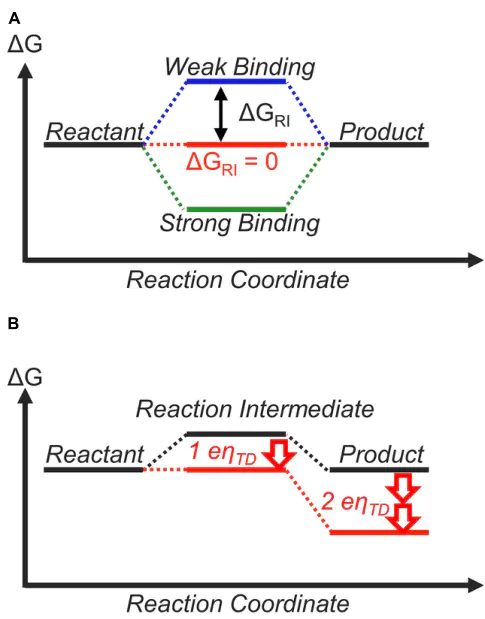
CH吸附能与多种金属表面上吸附能之间的标度关系。:从热力学角度来看,自由能形貌在平衡时应该是完全平坦的,以获得理想的催化剂。即使在涉及两个以上基本步骤的情况下也是如此。然而,在实践中,对于,而对OER2O+ 4H+ 4e)则更为困难这反映在实验文献中,一些催化剂,如Pt,。
2OER/ORR2图4 在(黑色线)和(蓝色线)时的理想OER催化剂的热力学图。相对能量用红色字母表示。:10.3389/fenrg.2021.654460
是一个四电子过程假定OH、O和OOH吸附中间体作为反应中间体在图5中,表示OER催化剂的活性位点。为了实现理想的催化剂,每一步都必须在平衡电位下达到热力学上理想的状态。
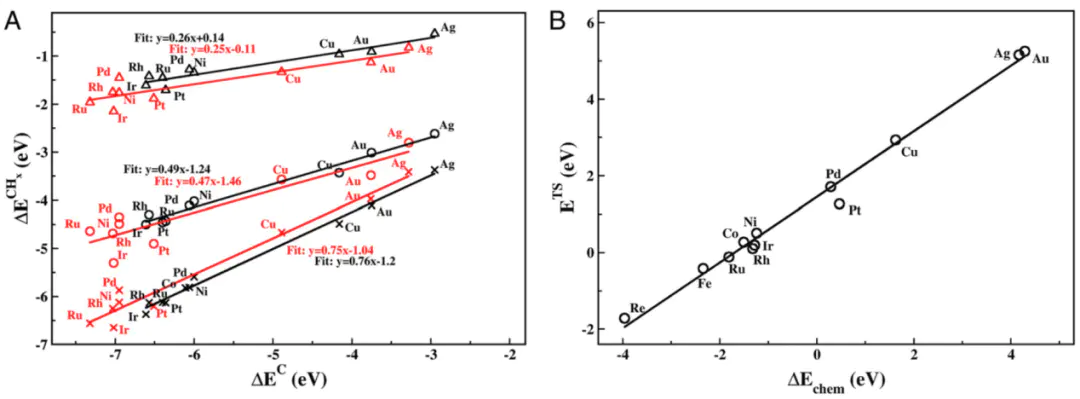
Gi1234在U=1.23时,U=0RHEΔG=ΔG=ΔG=ΔG=1.23eVCHEDFT然而,到目前为止,还没有发现接近热力学理想催化剂要求的电极材料。这是因为。例如,已知和OOH吸附物的结合能表现出线性相关关系。
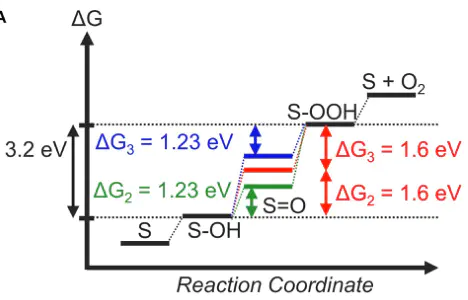
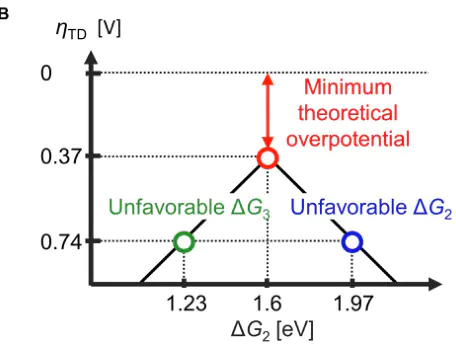
A23),无法同时将和调整到,当ΔG+ΔG=1.6eVB2DOI图6 (a)不同氧化物表面与吸附能的标度关系(b-f)通过引入吸附物特异性稳定作用突破标度关系的策略示例。:ddd,其物理意义是电子能量的重心位置。其数学表达式为:
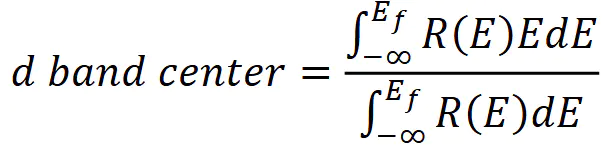
E是结合能,R(E)是背景减去后的UPS强度/轨道的投影态密度(pDOS),Ef是费米能级。
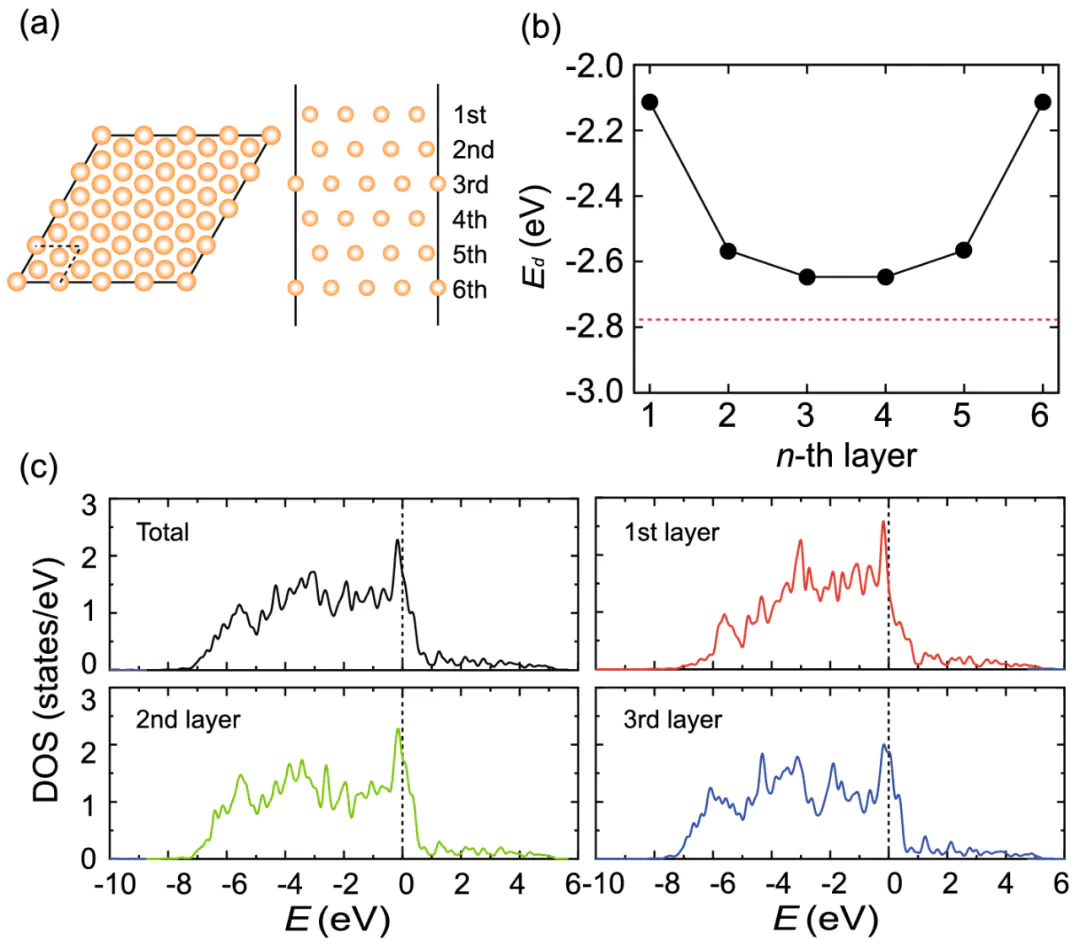
aPtbPtcDOSDOI10.1007/s40042-023-00934-3
d带中心与吸附强度
带中心位置决定吸附强度,远离费米能级时吸附减弱d此外,s吸附物态与金属d态之间反键态的占据程度d态能级相对于费米能级越高时,反键态的未占据程度越大,吸附键强度也就越强图8 过渡金属表面的键合形成。:活性描述符物理或化学参数吸附自由能是最核心的一类描述符。
析氢应氢吸附自由能(ΔG)0 eV在中,的吸附自由能及其组合(如ΔG− ΔG)是预测活性的关键。
电催化二氧化碳还原CO*、OCHO*等关键中间体图9各种材料的交换电流密度与其对应ΔG关系的火山图。:图10()ΔOOHG的bOERcOERdDOI: 10.1002/advs.202301706
电子结构描述符
带中心理论dd带中心越高,吸附通常越强,反之亦然图11带模型应用示意图。电化学测量数据显示,多种金属基底上钯覆盖层的氢吸附能(E)变化与计算的带中心位移(δε)高度吻合。:e轨道占据OERge轨道填充接近于时通常表现出最高的OER活性图12电子、e电子、容忍度及电荷转移能相对活性趋势的置信带图。DOI:电负性离子电负性(AIE)广义配位数()和结构描述符(φ)键长与键角